摘要:研究發(fā)現(xiàn):在DSS誘導(dǎo)的結(jié)腸炎模型中,Alox15-KI小鼠因結(jié)腸組織RvD5水平顯著升高而表現(xiàn)出抗炎保護。
研究背景:種屬差異困擾下的脂氧合酶之謎
在炎癥疾病研究中,脂氧合酶ALOX15一直扮演著矛盾角色——它既能促進炎癥消退,又能加劇病理損傷。這種雙重身份因哺乳動物間的催化特異性差異而更加復(fù)雜:人類ALOX15催化花生四烯酸(AA)生成15-氫過氧化二十碳四烯酸(15-H(p)ETE),而小鼠同源酶Alox15卻主要產(chǎn)生12-加氧產(chǎn)物(12-H(p)ETE)。由于15-脂氧合路徑更高效合成特化促消退介質(zhì)(SPMs),傳統(tǒng)小鼠模型難以準(zhǔn)確模擬人類ALOX15的生物學(xué)功能,嚴(yán)重阻礙了轉(zhuǎn)化研究。
 圖1 功能性人源化15-脂氧合酶-1 (Alox15) 保護小鼠免受葡聚糖硫酸鈉誘導(dǎo)的腸道炎癥
圖1 功能性人源化15-脂氧合酶-1 (Alox15) 保護小鼠免受葡聚糖硫酸鈉誘導(dǎo)的腸道炎癥研究策略:基因編輯破解種屬壁壘
為破解這一難題,德國柏林夏里特醫(yī)學(xué)院(Charité-Universit?tsmedizin Berlin)與波茨坦大學(xué)的研究團隊采用CRISPR/Cas9技術(shù),構(gòu)建了攜帶Leu353Phe突變的Alox15基因敲入小鼠(Alox15-KI)。該突變使人源化小鼠Alox15從12-脂氧合酶轉(zhuǎn)變?yōu)?5-脂氧合酶,從而在遺傳背景一致的模型中直接比較催化特異性對炎癥的影響。研究通過兩種經(jīng)典模型評估其功能:
腸道炎癥:葡聚糖硫酸鈉(DSS)誘導(dǎo)結(jié)腸炎
外周炎癥:弗氏完全佐劑(CFA)誘導(dǎo)足爪水腫
關(guān)鍵技術(shù)方法
基因編輯與驗證:CRISPR/Cas9介導(dǎo)Alox15 Leu353Phe點突變,通過腹腔灌洗細(xì)胞和骨髓細(xì)胞離體活性檢測驗證人源化酶功能(RP-HPLC/手性色譜分析產(chǎn)物譜)。
雙炎癥模型:
DSS模型(1.5%飲水8天):以體重、結(jié)腸長度、組織學(xué)評分、促炎基因表達(qRT-PCR)為指標(biāo)
CFA模型(50μg分枝桿菌懸液足墊注射):以足爪容積、機械/熱痛敏(von Frey/Hargreaves測試)、細(xì)胞因子表達為指標(biāo)
脂質(zhì)組學(xué)分析:固相萃取結(jié)合LC-MS/MS定量結(jié)腸組織40+種氧脂素(oxylipins),包括SPMs(RvD5、Mar-2、NPD-1)和經(jīng)典介質(zhì)(LTB4)。
研究結(jié)果:人源化ALOX15的疾病特異性保護
1. 人源化酶成功重塑脂氧合譜系
離體驗證:Alox15-KI小鼠腹腔細(xì)胞催化AA生成15-HETE比例提升至90%(野生型僅8%),且15-HEPE、17-HDHA等15/17-加氧產(chǎn)物在結(jié)腸組織顯著升高(*p<0.01)。< div=""> 圖1 功能性人源化15-脂氧合酶-1 (Alox15) 保護小鼠免受葡聚糖硫酸鈉誘導(dǎo)的腸道炎癥
圖1 功能性人源化15-脂氧合酶-1 (Alox15) 保護小鼠免受葡聚糖硫酸鈉誘導(dǎo)的腸道炎癥
關(guān)鍵SPMs變化:結(jié)腸RvD5水平在Alox15-KI小鼠中持續(xù)高于野生型,而Mar-2因14-HDHA生成受阻顯著降低,證實突變特異性改變SPMs合成能力。
2. DSS結(jié)腸炎:RvD5介導(dǎo)的腸炎保護
表型保護:Alox15-KI小鼠體重?fù)p失更輕,結(jié)腸縮短程度在恢復(fù)期基本逆轉(zhuǎn),組織炎癥評分降低。
機制關(guān)聯(lián):
促炎基因(iNOS、TNFα)表達增幅弱于野生型
RvD5升高與保護表型強相關(guān)(*p<0.05),而mar-2、npd-1未顯示保護效應(yīng)< div="">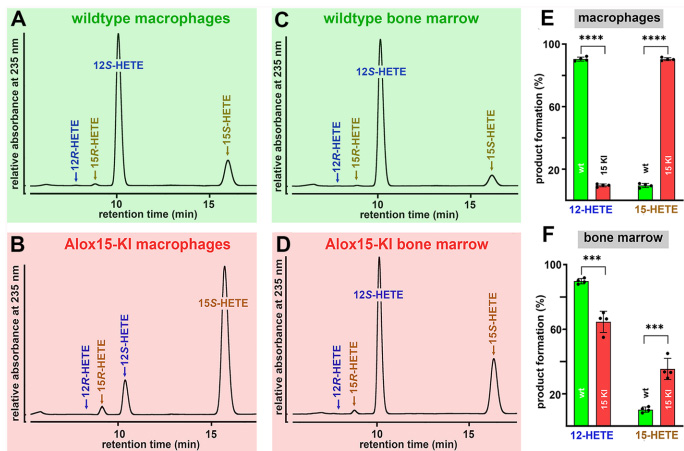
圖2 Leu353Phe突變使人源化小鼠Alox15從12-脂氧合酶轉(zhuǎn)變?yōu)?5-脂氧合酶
LTB4(促炎介質(zhì))無組間差異,排除ALOX5通路干擾
3. CFA足爪水腫:保護作用缺失
足爪腫脹度、機械/熱痛敏、促炎因子(iNOS、IL-1β、IL-6)表達在兩組間無差異,表明ALOX15人源化對急性外周炎癥無調(diào)節(jié)作用。

圖2 Leu353Phe突變使人源化小鼠Alox15從12-脂氧合酶轉(zhuǎn)變?yōu)?5-脂氧合酶
結(jié)論與意義:靶向SPMs的精準(zhǔn)調(diào)控新視角
本研究首次通過基因編輯實現(xiàn)哺乳動物ALOX15功能人源化,揭示兩個關(guān)鍵機制:
疾病特異性:人源化ALOX15通過提升結(jié)腸RvD5生成緩解DSS腸炎,但對CFA足爪水腫無效,提示其抗炎效應(yīng)具有組織微環(huán)境依賴性。
SPMs優(yōu)先級:RvD5(而非Mar-2或NPD-1)是介導(dǎo)腸炎保護的核心介質(zhì),為SPMs的靶向治療提供新方向。
轉(zhuǎn)化價值:
模型革新:Alox15-KI小鼠克服了種屬催化差異,成為研究人類ALOX15功能的理想工具。
藥物研發(fā):針對RvD5合成通路的激動劑或可成為結(jié)腸炎治療新策略。
臨床啟示:ALOX15在炎癥中的"雙面性"可能源于其產(chǎn)物譜的組織特異性代謝,未來需探索不同SPMs在局部炎癥中的協(xié)同/拮抗關(guān)系。
參考資料
[1] Functional humanization of 15-lipoxygenase-1 (Alox15) protects mice from dextran sodium sulfate induced intestinal inflammation
摘要:研究發(fā)現(xiàn):在DSS誘導(dǎo)的結(jié)腸炎模型中,Alox15-KI小鼠因結(jié)腸組織RvD5水平顯著升高而表現(xiàn)出抗炎保護。
研究背景:種屬差異困擾下的脂氧合酶之謎
在炎癥疾病研究中,脂氧合酶ALOX15一直扮演著矛盾角色——它既能促進炎癥消退,又能加劇病理損傷。這種雙重身份因哺乳動物間的催化特異性差異而更加復(fù)雜:人類ALOX15催化花生四烯酸(AA)生成15-氫過氧化二十碳四烯酸(15-H(p)ETE),而小鼠同源酶Alox15卻主要產(chǎn)生12-加氧產(chǎn)物(12-H(p)ETE)。由于15-脂氧合路徑更高效合成特化促消退介質(zhì)(SPMs),傳統(tǒng)小鼠模型難以準(zhǔn)確模擬人類ALOX15的生物學(xué)功能,嚴(yán)重阻礙了轉(zhuǎn)化研究。
 圖1 功能性人源化15-脂氧合酶-1 (Alox15) 保護小鼠免受葡聚糖硫酸鈉誘導(dǎo)的腸道炎癥
圖1 功能性人源化15-脂氧合酶-1 (Alox15) 保護小鼠免受葡聚糖硫酸鈉誘導(dǎo)的腸道炎癥研究策略:基因編輯破解種屬壁壘
為破解這一難題,德國柏林夏里特醫(yī)學(xué)院(Charité-Universit?tsmedizin Berlin)與波茨坦大學(xué)的研究團隊采用CRISPR/Cas9技術(shù),構(gòu)建了攜帶Leu353Phe突變的Alox15基因敲入小鼠(Alox15-KI)。該突變使人源化小鼠Alox15從12-脂氧合酶轉(zhuǎn)變?yōu)?5-脂氧合酶,從而在遺傳背景一致的模型中直接比較催化特異性對炎癥的影響。研究通過兩種經(jīng)典模型評估其功能:
腸道炎癥:葡聚糖硫酸鈉(DSS)誘導(dǎo)結(jié)腸炎
外周炎癥:弗氏完全佐劑(CFA)誘導(dǎo)足爪水腫
關(guān)鍵技術(shù)方法
基因編輯與驗證:CRISPR/Cas9介導(dǎo)Alox15 Leu353Phe點突變,通過腹腔灌洗細(xì)胞和骨髓細(xì)胞離體活性檢測驗證人源化酶功能(RP-HPLC/手性色譜分析產(chǎn)物譜)。
雙炎癥模型:
DSS模型(1.5%飲水8天):以體重、結(jié)腸長度、組織學(xué)評分、促炎基因表達(qRT-PCR)為指標(biāo)
CFA模型(50μg分枝桿菌懸液足墊注射):以足爪容積、機械/熱痛敏(von Frey/Hargreaves測試)、細(xì)胞因子表達為指標(biāo)
脂質(zhì)組學(xué)分析:固相萃取結(jié)合LC-MS/MS定量結(jié)腸組織40+種氧脂素(oxylipins),包括SPMs(RvD5、Mar-2、NPD-1)和經(jīng)典介質(zhì)(LTB4)。
研究結(jié)果:人源化ALOX15的疾病特異性保護
1. 人源化酶成功重塑脂氧合譜系
離體驗證:Alox15-KI小鼠腹腔細(xì)胞催化AA生成15-HETE比例提升至90%(野生型僅8%),且15-HEPE、17-HDHA等15/17-加氧產(chǎn)物在結(jié)腸組織顯著升高(*p<0.01)。< div="">
關(guān)鍵SPMs變化:結(jié)腸RvD5水平在Alox15-KI小鼠中持續(xù)高于野生型,而Mar-2因14-HDHA生成受阻顯著降低,證實突變特異性改變SPMs合成能力。
2. DSS結(jié)腸炎:RvD5介導(dǎo)的腸炎保護
表型保護:Alox15-KI小鼠體重?fù)p失更輕,結(jié)腸縮短程度在恢復(fù)期基本逆轉(zhuǎn),組織炎癥評分降低。
機制關(guān)聯(lián):
促炎基因(iNOS、TNFα)表達增幅弱于野生型
RvD5升高與保護表型強相關(guān)(*p<0.05),而mar-2、npd-1未顯示保護效應(yīng)< div="">
圖2 Leu353Phe突變使人源化小鼠Alox15從12-脂氧合酶轉(zhuǎn)變?yōu)?5-脂氧合酶
LTB4(促炎介質(zhì))無組間差異,排除ALOX5通路干擾
3. CFA足爪水腫:保護作用缺失
足爪腫脹度、機械/熱痛敏、促炎因子(iNOS、IL-1β、IL-6)表達在兩組間無差異,表明ALOX15人源化對急性外周炎癥無調(diào)節(jié)作用。

圖2 Leu353Phe突變使人源化小鼠Alox15從12-脂氧合酶轉(zhuǎn)變?yōu)?5-脂氧合酶
結(jié)論與意義:靶向SPMs的精準(zhǔn)調(diào)控新視角
本研究首次通過基因編輯實現(xiàn)哺乳動物ALOX15功能人源化,揭示兩個關(guān)鍵機制:
疾病特異性:人源化ALOX15通過提升結(jié)腸RvD5生成緩解DSS腸炎,但對CFA足爪水腫無效,提示其抗炎效應(yīng)具有組織微環(huán)境依賴性。
SPMs優(yōu)先級:RvD5(而非Mar-2或NPD-1)是介導(dǎo)腸炎保護的核心介質(zhì),為SPMs的靶向治療提供新方向。
轉(zhuǎn)化價值:
模型革新:Alox15-KI小鼠克服了種屬催化差異,成為研究人類ALOX15功能的理想工具。
藥物研發(fā):針對RvD5合成通路的激動劑或可成為結(jié)腸炎治療新策略。
臨床啟示:ALOX15在炎癥中的"雙面性"可能源于其產(chǎn)物譜的組織特異性代謝,未來需探索不同SPMs在局部炎癥中的協(xié)同/拮抗關(guān)系。
參考資料
[1] Functional humanization of 15-lipoxygenase-1 (Alox15) protects mice from dextran sodium sulfate induced intestinal inflammation



